Switch
Switch: So werden verschreibungspflichtige Arzneimittel rezeptfrei
Der Begriff „Switch“ beschreibt die Entlassung eines verschreibungspflichtigen Arzneimittels aus der Rezeptpflicht. Pharma Deutschland wird sich für die weitere Optimierung des Verfahrens einsetzen.
Doch wie laufen Switch-Verfahren in Deutschland und der EU eigentlich ab und wer entscheidet letztendlich, ob ein rezeptpflichtiges Arzneimittel aus der Verschreibungspflicht entlassen wird?
[glossar] Mehr Beteiligungsrechte von Antragstellern im Switch-Verfahren – wichtiger Erfolg der Arbeit von Pharma Deutschland :::
Seit langem setzt sich Pharma Deutschland für eine Verbesserung der Beteiligungsmöglichkeiten der Antragsteller bei dem Verfahren zur Entlassung von Wirkstoffen aus der Verschreibungs- in die Apothekenpflicht – dem sogenannten „Switch“ – ein. Im Mittelpunkt der Diskussion stand stets die Frage, ob ein Antragsteller das Recht erhalten soll, bei den Sitzungen des Verschreibungsausschusses seinen Antrag vorzustellen und zuvor die entsprechende Empfehlung des BfArM zu erhalten. Dies war lange aufgrund der geltenden Geschäftsordnung des Ausschusses nicht möglich. Die von Pharma Deutschland vorgetragenen Argumente wurden im Oktober 2020 in wichtigen Punkten aufgegriffen und Änderungen am Verfahren durch Anpassungen der Geschäftsordnung umgesetzt. [/glossar]
[glossar] Beispiel für einen Switch: die „Pille danach“ :::
Fachkreise und Politiker diskutieren immer wieder, ob bestimmte rezeptpflichtige Arzneimittel aus der Verschreibungspflicht entlassen werden sollen. Ein Beispiel hierfür ist der Wirkstoff Levonorgestrel – besser bekannt als die „Pille danach“.
Der Sachverständigenausschuss für Verschreibungspflicht hat sich Anfang 2014 erneut, wie schon zehn Jahre zuvor, für einen sogenannten Switch, also für die Entlassung aus der Verschreibungspflicht, ausgesprochen. Der Deutsche Bundesrat stimmte dieser Empfehlung zu. Das Bundesgesundheitsministerium hat sich zunächst dagegen gewandt.
Nachdem die EU-Kommission Anfang 2015 die Rezeptpflicht für den zentral für die ganze EU als Notfallkontrazeptivum zugelassenen Wirkstoff Ulipristal europaweit aufgehoben hat, wurde auch Levonorgestrel nun in Deutschland aus der Verschreibungspflicht entlassen.
Seit Mitte März 2015 ist der Wirkstoff auch ohne Rezept erhältlich. [/glossar]
[glossar] Deutsches Verfahren bei Änderungen der Verschreibungspflicht :::
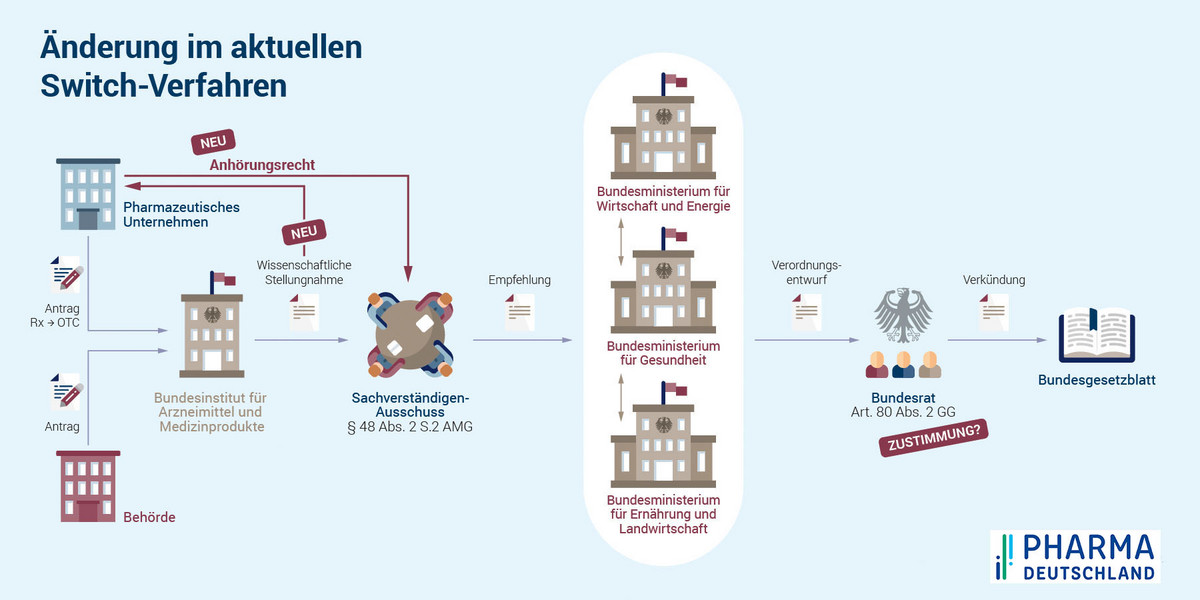
Zentrale Akteure im Switch-Verfahren sind der Arzneimittel-Hersteller, die zuständige Bundesoberbehörde (in den überwiegenden Fällen also das Bundesinstitut für Arzneimittel und Medizinprodukte (BfArM)), der beim BfArM ansässige Sachverständigenausschuss für Verschreibungspflicht, das Bundesministerium für Gesundheit (BMG) und der Bundesrat mit seinem Gesundheitsausschuss.
Das Verfahren startet in der Regel mit einem Antrag des Arzneimittel-Herstellers auf Entlassung eines Arzneimittels aus der Verschreibungspflicht. Anschließend muss die zuständige Bundesoberbehörde den Antrag prüfen. Nach Prüfung auf Vollständigkeit und Schlüssigkeit wird der Antrag auf die Tagesordnung der nächsten Sitzung des Sachverständigenausschusses genommen. Dieser tagt in der Regel zweimal jährlich.
Die Bundesoberbehörde erstellt zu dem Antrag eine Stellungnahme, die die Ausschussmitglieder vorab erhalten. Auf Basis dieser Unterlagen bewertet der Ausschuss den Antrag und verabschiedet eine Empfehlung gegenüber dem BMG.
Diese Empfehlung ist nicht bindend; das BMG kann die Empfehlung umsetzen, modifizieren oder ablehnen. Wenn das BMG zugestimmt hat, wird ein Entwurf einer Verordnung zur Änderung der Arzneimittelverschreibungsverordnung (AMVV) dem Bundesrat zur Zustimmung zugeleitet, der wiederum seinen Gesundheitsausschuss mit der Prüfung befasst.
Die Zustimmung des Bundesrates war in der Vergangenheit eher eine Formsache; inhaltliche Änderungen waren äußerst selten. In jüngster Zeit bringt sich der Bundesrat jedoch aktiver in diesen Prozess ein. Das ganze Verfahren nimmt von der Antragstellung bis zur Publikation im Bundesgesetzblatt im günstigsten Fall rund sechs Monate in Anspruch, kann aber auch bedeutend länger dauern oder ganz scheitern. [/glossar]
[glossar] Europäischer Switch: Eine interessante Alternative :::
Die Einstufung eines Wirkstoffs als verschreibungspflichtig oder nicht ist in Europa eine rein nationale Angelegenheit. Jeder Mitgliedstaat hat hierzu eigene Verfahren mit nationalen Besonderheiten entwickelt.
Dies macht es einem international operierenden Unternehmen nicht leicht, europaweit ein Produkt in den OTC-Status – sprich in den verschreibungsfreien Zustand (over-the-counter) – zu überführen. Einen Wirkstoff in der EU zentral zu „switchen“ hat deshalb eine hohe Attraktivität.
Ein zentraler Switch muss bei der europäischen Zulassungsbehörde (EMA) beantragt und im Europäischen Ausschuss für Humanarzneimittel (CHMP) diskutiert werden. Der CHMP erstellt eine Empfehlung und die Europäische Kommission fällt abschließend eine Entscheidung. Soll der Wirkstoff aus der Verschreibungspflicht entlassen werden, ist diese Entscheidung in allen EU-Mitgliedstaaten bindend.
Die Vorteile einer zentralen Entlassung aus der Verschreibungspflicht in der Europäischen Union sind auf den ersten Blick bestechend, erhält man auf diese Weise doch sofort Zugang zum gesamten EU-Markt.
Jedoch gibt es auch Nachteile: Nach Rechtsauffassung der Europäischen Kommission kann es kein Nebeneinander von wirkstoffgleichen Produkten mit zentraler und nationaler Zulassungen und auch keinen Raum für eine zusätzliche wissenschaftliche Bewertung und regulatorische Entscheidungen für das gleiche Arzneimittel auf nationaler Ebene geben.
Wenn die europäische Entscheidung negativ ausfällt, es also keine EU-weite Entlassung aus der Verschreibungspflicht gibt, dürfen anschließend keine national begrenzten Entlassungsanträge mehr gestellt werden. [/glossar]
[glossar] Pharma Deutschland fordert mehr Pragmatismus und Transparenz :::
In den letzten Jahren führten immer wieder regulatorische Probleme zu langen Verzögerungen bei der Umsetzung von Empfehlungen des Sachverständigenausschusses für Verschreibungspflicht; in manchen Fällen erfolgt die Umsetzung überhaupt nicht, obwohl die betroffenen Substanzen unstrittig für die Selbstmedikation geeignet waren.
Wünschenswert wäre es, wenn die zuständigen Behörden frühzeitig mit dem Antragsteller in Dialog treten und mögliche Handlungsoptionen diskutieren. Als besonders pragmatisch in diesem Sinne hat sich die britische Zulassungsbehörde erwiesen; in Deutschland besteht diesbezüglich noch Potenzial.
Vor diesem Hintergrund hat Pharma Deutschland zusammen mit einer Gruppe von Experten zuletzt im Jahr 2019 Vorschläge erarbeitet, das Switch-Verfahren transparenter und effizienter zu gestalten.
Das BfArM und das BMG haben einige der Anregungen aufgegriffen und bereits in die Praxis umgesetzt. So werden seit kurzem die Beschlüsse des Ausschusses erheblich ausführlicher protokolliert. Zudem hat das BfArM mit Zustimmung des BMG und des Sachverständigenausschusses für Verschreibungspflicht die Geschäftsordnung des Ausschusses aktualisiert und gewährt Antragstellern und betroffenen Unternehmen mehr Beteiligungsrechte. [/glossar]
Switches in Deutschland seit 2005
| 2025 | Azelastin | bei Symptomen allergischer Erkrankungen |
| Fluticason | Asthma bei Erwachsenen und Jugendlichen ab 12 Jahren | |
| 2024 | Rizatriptan | Migräne |
| Bilastin | Heuschnupfen (Kinder von 6 bis 11 Jahren) | |
| 2022 | Bilastin | Heuschnupfen (Erwachsene und Kinder ab 12 Jahren) |
| Dexibuprofen | leichte bis mäßig starke Schmerzen | |
| Kombinationen Ibuprofen und Paracetamol | leichte bis mäßig starke Schmerzen | |
| Levodropropizin | Reizhusten | |
| 2020 | Sumatriptan | Migräne |
| 2020 | Desloratadin | Heuschnupfen |
| 2019 | Diclofenac | Schmerzen (Pflaster; modifizierte Position) |
| Levocetiricin | Heuschnupfen | |
| 2018 | Ibuprofen plus Coffein | Schmerzen |
| 2017 | Aciclovir-Hydrocortison-Kombination | Lippenherpes |
| Ibuprofen | Schmerzen (Pflaster, 6 % Wirkstoffgehalt) | |
| 2016 | Fluticason | Heuschnupfen (nasale Form) |
| Mometason | Heuschnupfen (nasale Form) | |
| Racecadotril | Durchfall (auch Kinder ab 12 J.) | |
| 2015 | Levonorgestrel | Notfallkontrazeption |
| Ulipristal | Notfallkontrazeption | |
| Esomeprazol | Sodbrennen und saures Aufstoßen | |
| Flurbiprofen | Entzündungen der Rachenschleimhaut | |
| Ketotifen | Anwendung am Auge | |
| 2013 | Racecadotril | Durchfall (Erwachsene) |
| Benzydamin | Entzündungen im Mund- und Rachenraum | |
| Ibuprofen-Pseudo-ephedrin-Kombination | Erkältungssymptome | |
| 2012 | Nicotin | Erhöhung Menge auf 15 mg je abgeteilter Form |
| 2011 | Orlistat | Erweiterung der Position auf national zugelassene Arzneimittel |
| 2010 | Pantoprazol | Refluxsymptome (von der EU-Kommission europaweit zugelassen) |
| 2009 | Almotriptan | Migräne |
| Omeprazol | Sodbrennen und saures Aufstoßen | |
| Orlistat | Adipositas (von der EU-Kommission europaweit zugelassen) | |
| 2007 | Hydrocortison | Topische Anwendung (Erhöhung der Einzeldosis) |
| Diclofenac | Erhöhung der Einzeldosis | |
| 2006 | Naratriptan | Migräne |
| 2005 | Penciclovir | Lippenherpes |
| Ibuprofen | Migräne mit oder ohne Aura | |
| Miconazol | Pilzerkrankungen der Mundhöhle | |
| Minoxidil | Haarausfall |