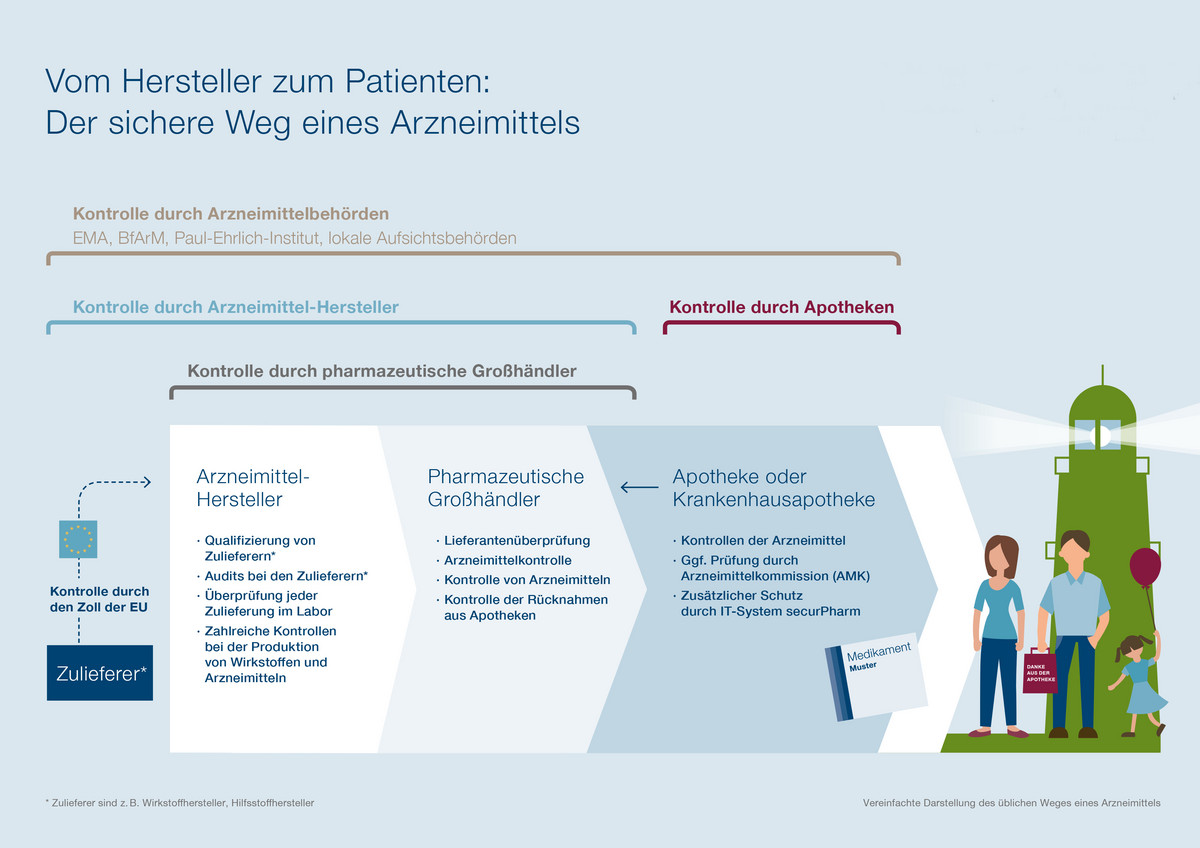
Sichere Lieferkette
Der Weg von der Herstellung eines Medikamentes bis zur Belieferung der Apotheke ist eine der am strengsten kontrollierten Herstellungs- und Lieferketten überhaupt. Die engmaschigen Kontrollen von Behörden, Arzneimittel-Herstellern, Großhändlern und Apotheken sorgen dafür, dass eventuelle Medikamenten-Fälschungen erst gar nicht zum Patienten gelangen.
[glossar] Prüfung durch den Arzneimittel-Hersteller und zusätzliche Sicherheitsmerkmale :::
Arzneimittel-Hersteller überprüfen ihre Produktion mit zahlreichen Qualitätstests, ebenso die ihrer Zulieferer. Dazu gehört, dass jede eingehende Charge einer Zulieferung mit chemisch-analytischen Methoden auf Echtheit, Konzentration und Reinheit kontrolliert wird. Zudem führen die Unternehmen Audits bei ihren Zulieferern durch, um festzustellen, dass bestimmungskonform produziert wird.
Einige Arzneimittel-Hersteller statten bestimmte Medikamente mit zusätzlichen Sicherheitsmerkmalen aus, z.B. mit einem Fluoreszenz-Marker, mit DNA-haltiger Druckfarbe oder einem Erstöffnungsschutz (etwa einem Siegel über der Lasche, durch das es offensichtlich wird, wenn die Packung geöffnet wurde).
[/glossar]
[glossar] Prüfung durch die Behörden :::
Die Arzneimittelbehörden kontrollieren die Arbeit der Arzneimittel-Hersteller und ihrer Zulieferer. Sie nehmen dazu selbst Proben und überprüfen die Ergebnisse unternehmenseigener Kontrollen. Sie kontrollieren außerdem die Großhändler, die Apotheken und die Parallelimporteure.
Diese Kontrollen werden von der europäischen Arzneimittelbehörde EMA, der US-amerikanischen Behörde FDA, den deutschen Zulassungsbehörden BfArM und Paul-Ehrlich-Institut und weiteren Behörden weltweit durchgeführt – auch in Produktionsstätten außerhalb von EU und USA. [/glossar]
[glossar] Erstöffnungsschutz und packungsindividuelle Seriennummern :::
Ein zusätzlicher Schutz wurde eingeführt: Um die Sicherheit in der regulären Lieferkette EU-weit noch weiter zu erhöhen, tragen seit Februar 2019 die Packungen verschreibungspflichtiger Arzneimittel einen Erstöffnungsschutz, so dass sie nicht unbemerkt geöffnet werden können. Zudem werden sie durch einen Scan in der Apotheke zusätzlich auf Echtheit geprüft. Sie erhalten dafür packungsindividuelle Seriennummern. Die Organisation securPharm hat den deutschen Teil dieses Systems aufgebaut. Mehr dazu finden Sie auf der SecurPharm Webseite und unserer Themenseite Das securPharm-System. [/glossar]
Übersicht über die Kontrollmechanismen
Wie sehen die Kontrollen der Herstellung und des Vertriebes von Arzneimitteln eigentlich genau aus? Hier stellen wir Ihnen die Kontrollmechanismen im Detail vor.
[glossar] Kontrolle der Ausgangsstoffe (Wirkstoffe, Hilfsstoffe, Verpackung) :::
WIRKSTOFFE
- Anzeigepflicht: Alle Wirkstoff-Hersteller in Europa müssen ihre Tätigkeit bei der zuständigen Behörde anzeigen. Für bestimmte Wirkstoffe bedarf es sogar einer Herstellungserlaubnis für den Wirkstoff-Hersteller.
- Qualitätssicherungsvereinbarung (Technical Agreement): Hier regelt der Hersteller bis ins kleinste Detail die Zuständigkeiten und Verantwortlichkeiten des Wirkstoff-Herstellers. Es wird z.B. festgehalten, welche Firma welchen Wirkstoff herstellt und welche Personen die jeweiligen Ansprechpartner sind.
- Bewertung von Lieferanten: Der Arzneimittel-Hersteller auditiert den Wirkstofflieferanten und muss die Ergebnisse der zuständigen Landesoberbehörde auf Anfrage vorgelegen können. Alternativ können für Audits auch „Dritte“ beauftragt werden, z.B. externe Audit-Agenturen. Diese können jedoch nicht wahllos ausgesucht werden. Der Arzneimittel-Hersteller muss auch die externen Audit-Agenturen enzsprechend qualifizieren.
- Einfuhrerlaubnis §§ 72 und 72a AMG (Import aus Drittländern): Ein Wirkstoffhersteller aus einem Nicht-EU-Land (mit Ausnahme von Island, Liechtenstein und Norwegen) benötigt ein Zertifikat seiner nationalen Überwachungsbehörde, dass bei der Herstellung GMP-Regeln (Good Manufacturing Practice Regulations – gute Herstellungspraxis) eingehalten wurden, die mindestens den EU-Regeln gleichwertig sind. Auch beinhaltet das Zertifikat alle wichtigen Informationen über die Firma, so z.B. Name, Anschrift und die exakte Benennung der Wirkstoffe, die produziert werden. Dies gewährleistet eine lückenlose Überwachung der Lieferkette.
- Wareneingangskontrollen, Probenahme und analytische Untersuchung, Analysenzertifikate, Spezifikationen: Bereits beim Eingang der Ware gibt es Kontrollen durch den Arzneimittel-Hersteller, darüber hinaus werden Proben des Wirkstoffes untersucht, um so die lückenlose Qualität des Wirkstoffs festzuhalten, bevor er zur Herstellung des Arzneimittels freigegeben wird.
HILFSSTOFFE
- Anzeigepflicht: Alle Hilfsstoff-Hersteller in Europa müssen ihre Tätigkeit bei der zuständigen Behörde anzeigen und mitteilen, welchen Hilfsstoff sie genau herstellen möchten.
- Qualitätssicherungsvereinbarung (Technical Agreement): Hier regelt der Arzneimittel-Hersteller zusammen mit dem Hilfsstoffhersteller bis ins kleinste Detail die Zuständigkeiten und Verantwortlichkeiten. Es wird z.B. festgehalten, welche Firma welchen Hilfsstoff herstellt und welche Personen die jeweiligen Ansprechpartner sind.
- Bewertung von Lieferanten/ Lieferantenqualifizierung/ Requalifizierung: Der Arzneimittel-Hersteller überprüft die Eignung des Lieferanten der Hilfsstoffe. Unter anderem können Audits zur Qualifizierung bei dem Lieferanten durchgeführt werden.
- Wareneingangskontrollen, Probenahme und analytische Untersuchung, Analysenzertifikate, Spezifikationen: Bereits beim Eingang der Ware gibt es Kontrollen, wobei Proben des Hilfsstoffes untersucht werden, um so die Qualität der Hilfsstoffe gewährleisten zu können.
VERPACKUNG
- Bewertung von Lieferanten/ Lieferantenqualifizierung/ Requalifizierung:
Der Arzneimittel-Hersteller überprüft die Eignung des Lieferanten der Verpackungsstoffe.
- Qualitätssicherungsvereinbarung (Technical Agreement): Der Arzneimittel-Hersteller hält mit dem Verpackungsbetrieb vertraglich fest, wer welche Zuständigkeiten hat und welche Qualitätsstandards einzuhalten sind. Ob diese Maßnahmen eingehalten worden sind, überprüft der Arzneimittel-Hersteller regelmäßig mit Audits.
- Wareneingangskontrollen, Probenahme und Untersuchung, Spezifikationen: Bereits beim Eingang der Verpackung im Lager gibt es Kontrollen. Das Lager selbst ist speziell abgesichert und zugangskontrolliert, so dass nur Befugten der Zutritt gewährt ist. [/glossar]
[glossar] Produktionsbetrieb :::
- Qualitätsmanagementsystem: Der Produktionsbetrieb muss ein funktionierendes Qualitätsmanagementsystem vorweisen, das die Anforderungen des EU-GMP-Leitfadens (Good Manufacturing Practice Regulations – gute Herstellungspraxis) erfüllt, z. B. zu Abweichungen, Change Control, zur Dokumentation, zur Untersuchung der Proben und zum Personal.
Dazu zählt beispielsweise die Qualifizierung der Herstellungsstätte: Die Räumlichkeiten, Maschinen und Anlagen werden qualifiziert, die Herstell- und Prüfverfahren werden validiert, und die Mitarbeiter des Produktionsbetriebes werden vom Arzneimittel-Hersteller auf die GMP-Regeln geschult. So wird ein EU-weiter einheitlicher Sicherheits- und Qualitätsstandard in der Herstellung des Arzneimittels gewährleistet.
- Herstellungserlaubnis (§ 13, 14 AMG): Für die Herstellung eines Arzneimittels ist immer eine Herstellungserlaubnis der jeweils zuständigen Behörde inkl. Inspektion (s. dazu weiter unten) notwendig. Auch ein Lohnhersteller, der im Auftrag des pharmazeutischen Unternehmers bestimmte Herstellungsschritte vornimmt, benötigt diese. Die Herstellungserlaubnis gewährleistet, dass die Herstellung und Prüfung des Arzneimittels nach der EU-weit geltenden Guten Herstellungspraxis (GMP-Regeln) erfolgt sind.
- Protokolle: Neben den Wareneingangskontrollen und Probenahmen für die analytischen Untersuchungen der Ausgangsstoffe (Wirk- und Hilfsstoffe) (siehe hierzu oben) finden während der Herstellung zahlreiche In-prozess-Kontrollen bezüglich der Qualität statt. Das heißt: Alle Herstellungs- und Verpackungsaktivitäten müssen detailgenau in einem Herstellungsprotokoll dokumentiert werden, verantwortlich dafür ist die Leitung der Herstellung.
Das gleiche gilt für die Prüfungen, hierfür wird ein Prüfprotokoll angefertigt. Verantwortlich hierfür ist die Leitung der Qualitätskontrolle.
- Freigabe durch eine Sachkundige Person: Bevor eine Charge eines Arzneimittels für den Markt freigegeben wird, muss eine Sachkundige Person nochmals alles prüfen. Das heißt, sie ist dafür verantwortlich, dass die arzneimittelrechtlichen Vorschriften über die Lieferkette der Ausgangsstoffe, die Herstellung inklusive Verpackung und Kennzeichnung, die Prüfung, Freigabe und den ordnungsgemäßen Versand der Arzneimittel eingehalten worden sind. Die Sachkundige Person muss diese Informationen sowie die Freigabe dokumentieren. Eine Sachkundige Person ist für diesen Prozess persönlich haftbar und garantiert somit die Qualität des Arzneimittels.
- Großhandelserlaubnis (§ 52a AMG): Besitzt ein Arzneimittel-Hersteller keine Herstellungserlaubnis, bringt jedoch ein Arzneimittel von einem anderen Hersteller in Verkehr, benötigt er hierfür eine Großhandelserlaubnis. Diese gewährleistet den ordnungsgemäßen Vertrieb und die Lagerung nach der Guten Vertriebspraxis (Good Distribution Practice - GDP) und den korrekten Vertrieb.
- Inspektion (alle 2 Jahre durch zuständige Behörde) § 64 AMG, Inspektionen durch Behörden: Die zuständigen Überwachungsbehörden inspizieren vor Ort den Produktionsbetrieb, so dass Sicherheit und Qualität des Arzneimittels gewährleistet sind.
- Lohnherstellung (Contract Manufacturing Organisation – CMO): Hier regelt der pharmazeutische Unternehmer bis ins kleinste Detail die Aufgaben, Vorgehensweisen, Zuständigkeiten und Verantwortlichkeiten bei der Arzneimittel-Herstellung. [/glossar]
[glossar] Arzneimittel :::
- Einfuhrerlaubnis (§ 72, 72a AMG): Werden Arzneimittel aus Nicht-EU-Ländern (mit Ausnahme von Island, Liechtenstein und Norwegen) nach Europa importiert, ist eine Einfuhrerlaubnis der Behörden und ein GMP-Zertifikat einer europäischen Behörde vorzulegen. Das heißt, eine deutsche oder europäische Überwachungsbehörde inspiziert die (auswärtige) Herstellung nach den gleichen Kriterien wie eine heimische Inspektion. Das muss regelmäßig erfolgen. [/glossar]
[glossar] Vertrieb :::
- Qualifizierung der Vertriebsbetriebe: Der Arzneimittel-Hersteller überprüft die Großhandelserlaubnis der Betriebe, an die er Arzneimittel liefert und von denen er Arzneimittel bezieht.
- GDP-Inspektion: Die Überwachungsbehörde führt regelmäßig Vor-Ort Inspektionen bei der Vertriebsstätte durch.
- Qualitätssicherungsvereinbarungen: Das Speditionsunternehmen muss für den Transport von Arzneimitteln eine Qualitätssicherungsvereinbarung mit dem Arzneimittel-Hersteller geschlossen haben. Diese Vereinbarungen gewährleisten den sicheren und ordnungsgemäßen Transport des Arzneimittels. [/glossar]
[glossar] Apotheke :::
- Stichprobenkontrollen: In den Apotheken werden jährlich 6 Millionen Stichprobenkontrollen bei Arzneimittelpackungen durchgeführt.
- Dokumentation: Apotheker dokumentieren alle Arzneimittellieferungen.
- Meldung: Bei Verdacht auf Arzneimittelfälschungen oder Qualitätsmängel informiert der Apotheker umgehend die zuständige Behörde und die Arzneimittelkommission der Deutschen Apothekerschaft. [/glossar]
[glossar] Infografik Kontrollmechanismen :::
Die Infografik „Vom Hersteller zum Patienten: Der sichere Weg eines Arzneimittels“ finden Sie auch am Ende der Webseite als Download. [/glossar]